SOAL CADANGAN KIMIA
- PILIHAN GANDA
1. Unsur L dinotasikan sebagai berikut: Konfigurasi elektron dan letak unsur L pada tabel periodik, sesuai dengan golongan dan periodenya, secara berturut-turut adalah … ( Nomor atom Ne = 10)
|
|
Konfigurasi elektron |
Golongan |
Periode |
|
A. |
[Ne] 3S2 3p2 |
III A |
2 |
|
B. |
[Ne] 3S2 3p4 |
IV A |
2 |
|
C. |
[Ne] 3S2 3p2 |
V A |
3 |
|
D. |
[Ne] 3S2 3p4 |
VI A |
3 |
|
E. |
[Ne] 3S2 3p6 |
VII A |
4 |
2. Molekul BF3 tidak memiliki pasangan elektron bebas dan memiliki 3 pasang elektron ikatan . Bentuk geometri yang dapat terjadi pada molekul BF3 adalah ... .
- Trigonal planar
- Bentuk V
- Bentuk T
- Tetrahedron
- Oktahedron
3. Berikut ini adalah data fisik 3 buah senyawa tak dikenal :
|
Senyawa |
Mr |
Titik didih ºC |
Daya Hantar Listrik Larutannya |
|
P |
32 |
62 ºC |
Menghantarkan listrik |
|
Q |
34 |
-88 ºC |
Tidak menghantarkan arus listrik |
|
R |
26 |
867 ºC |
Menghantarkan listrik |
Jenis ikatan yang membentuk senyawa P , Q dan R berturut-turut adalah ….
- kovalen non polar , kovalen polar dan ionik
- kovalen polar , kovalen non polar dan ionik
- ionik , kovalen non polar dan kovalen polar
- kovalen polar , ionik dan kovalen non polar
- kovalen non polar , ionik dan kovalen polar
4. Reaksi logam besi dan belerang adalah :
Fe (s) + S ( s) → FeS (s)
Jika sebanyak 30 gram serbuk besi direaksikan dengan 16 gram belerang , massa besi sulfida yang dihasilkan sebesar … .( Ar S = 32, Fe = 56 )
- 2 gram
- 16 gram
- 32 gram
- 44 gram
- 46 gram
5. Salah satu reaksi kimia dalam kehidupan sehari – hari adalah reaksi pemanfaatan gas karbit untuk mengelas besi dari kalsium karbida dengan air menghasilkan gas asetilena dan kalsium hidroksida . persamaan reaksi yang setara untuk proses tersebut adalah …
- K2 CO3 + 3 H2O → 2 KOH + C2H2
- CaC2 + 2H2O → Ca(OH)2 + C2H2
- CaCO3 + H2O → CaOH + C2H4
- CaC2 + 3H2O → Ca(OH)2 + C2H2
- 2CaC2 + 2H2O → 2 Ca(OH)2 + C2H4
6. Berikut data hasil pengujian daya hantar listrik terhadap beberapa larutan:
|
Larutan |
Nyala lampu |
Gelembung gas di sekitar elektroda |
|
|
Elektroda positif |
Elektroda negatif |
||
|
1 2 3 4 5 |
Menyala terang Tidak menyala Menyala redup Tidak menyala Menyala redup |
Ada Ada Ada Tidak ada Tidak ada |
Ada Ada Ada Tidak ada Ada |
Dari data di atas yang tergolong elektrolit lemah dan nonelektrolit berturut-turut adalah ….
- 2 dan 4
- 4 dan 5
- 3 dan 4
- 1 dan 4
- 1 dan 3
7. Sekelompok siswa akan menentukan pH larutan X dan Ydengan beberapa indikator dengan data sebagai berikut!
|
Indikator |
Interval pH |
Perubahan warna |
Larutan X |
Larutan Y |
|
Timol Biru Brom timol Biru Fenolftalin (PP) |
1,2 – 2,8 6,0 – 7,6 8,3 – 10,1 |
Merah – kuning Kuning – Biru Tak berwarna – Merah |
Kuning Biru Tak berwarna |
Kuning Kuning Tak berwarna |
Berdasarkan data di atas disimpulkan pH larutan X dan Y berturut -turut adalah ….
- 1,2< pH < 2,8 dan 8,3 < pH < 10,1
- 2,8 < pH < 6,0 dan 7,6 < pH < 8,3
- 6,0 < pH < 7,6 dan 2,8 < pH < 6,0
- 7,6 < pH < 8,3 dan 2,8 < pH < 6,0
- 8,3 < pH < 10,1 dan 1,2< pH < 2,8
8. Perhatikan grafik titrasi antara basa dengan asam berikut !
Jika volume larutan KOHyang dititrasi sebanyak 30ml, konsentrasi larutan KOH adalah .....
- 0,1 M
- 0,2 M
- 0,3 M
- 0,4 M
- 0,5 M
9. Sekelompok siswa melakukan percobaan terhadap larutan dengan data hasil percobaan sebagai berikut!
|
No |
Larutan |
P |
Q |
R |
S |
T |
|
1 |
pH mula-mula |
7 |
5 |
1 |
9 |
13 |
|
2 |
Di tambah sedikit HCl |
2 |
4,9 |
1 |
8,9 |
10 |
|
3 |
Di tambah sedikit NaOH |
12 |
5,1 |
3,3 |
9,1 |
13 |
|
4 |
Di tambah air |
7 |
5 |
1,5 |
9 |
12 |
Dari data tersebut yang terrmasuk larutan yang bersifat penyangga adalah....
- P dan Q
- P dan R
- Q dan S
- Q dan T
- S dan T
10. Tabel pengujian larutan yang mengalami hidrolisis sebagai berikut!
|
Data |
Larutan |
Uji Lakmus |
|
|
Lakmus Merah |
Lakmus Biru |
||
|
1 |
NaCN |
Merah |
Merah |
|
2 |
CaF2 |
Biru |
Biru |
|
3 |
NH4Cl |
Merah |
Biru |
|
4 |
KCN |
Biru |
Biru |
|
5 |
CH3COONa |
Biru |
Biru |
Garam yang mengalami hidrolisis dan sesuai dengan uji lakmusnya adalah….
- 1, 2 dan 3
- 1, 3 dan 4
- 1, 4 dan 5
- 2, 3 dan 4
- 2, 4 dan 5
11. Diketahui data Ksp dari hidroksida alkali tanah sebagai berikut :
|
No. |
Hidroksida |
Ksp |
|
1. |
Ca(OH)2 |
5,5 x 10-9 |
|
2. |
Ba(OH)2 |
5,0 x 10-3 |
|
3. |
Mg(OH)2 |
1,8 x 10-11 |
|
4. |
Sr(OH)2 |
3,0 x 10-5 |
Apabila 10 mL larutan yang mengandung kation alkali tanah dengan konsentrasi 0,04 M dicampur dengan 10 mL larutan NaOH 0,04 M, maka hidroksida yang larut ( belum mengendap) adalah…
- 1, dan 3
- 2, dan 4
- 2 saja
- 3 saja
- 4 saja
12. Siswa melakukan percobaan dengan menggunakan beberapa sampel. Dari hasil percobaan diperoleh data sebagai berikut :
(1) H2O (s) → H2O (l) ∆H = + x kJ
(2) Na (s) + H2O (l) → NaOH (aq) + H2 (g) ∆H = - x kJ
(3) CO(NH2)2 (s) → CO(NH2)2 (aq) ∆H = + x kJ
(4) C2H5OH (aq) + 7/2O2 (g) → 2CO2 (g) + 3H2O (g) ∆H = - x kJ
Yang termasuk reaksi eksoterm adalah ....
- 1 dan 2.
- 2 dan 3
- 3 dan 4
- 1 dan 3
- 2 dan 4
13. Diketahui persamaan reaksi sebagai berikut!
C(s) + O2(g) → CO2 (g) ΔH = -300 kJ
2H2O(l) → 2H2(g) + O2(g) ΔH = -570 kJ
C2H2(g) + 2½O2(g) → 2CO2(g) + H2O(l) ΔH = -1300 kJ
Pada pembentukan 4,48 liter gas C2H2 (STP) disertai perubahan entalpi (ΔH) sebesar … .
- - 166 kJ
- - 83 kJ
- +83 kJ
- +166 kJ
- + 197 kj
14. Dari hasil percobaan reaksi : 2 NO(g) + Br2(g) ® 2 NOBr(g)
pada P,T tertentu diperoleh data sebagai berikut !
|
Dari data di atas maka persamaan laju reaksinya adalah ... .
- R = k [NO]2
- R = k [Br2]
- R = k [NO] [Br2]
- R = k [NO]2 [Br2]
- R = k [NO]2 [Br2]2
15. Proses pembuatan gas amoniak menurut proses Haber-Bosch adalah sebagai berikut!
N2 (g) + 3H2 (g) D 2NH3 (g) ΔH = -92 kJ
Untuk menghasilkan gas amoniak yang optimal maka tindakan yang harus dilakukan adalah ….
- Konsentrasi N2 diperkecil
- Konsentrasi NH3 diperbesar
- Tekanan diperbesar dan ditambahkan katalisator
- Tekanan dan volume diperbesar
- Volume dan suhu diperbesar
16. Dalam ruangan bervolume 5 liter terdapat 0,5 mol NH3, 1 mol N2 dan 0,5 mol H2, dalam keadaan seimbang, dengan reaksi 2NH3(g) Û N2(g) + 3H2(g) harga tetapan keseimbangan (Kc) reaksi tersebut adalah ….
17. Atom 15X dan 17Y bereaksi membentuk suatu senyawa. Hubungan yang tepat antara rumus molekul, bentuk molekul dan sifat kepolaran senyawa yang dihasilkan adalah ....
|
NO |
Rumus Senyawa |
Bentuk geometri molekul |
Sifat senyawa |
|
A |
XY2 |
linear |
Polar |
|
B |
XY3 |
Segitiga datar |
Non Polar |
|
C |
XY3 |
Piramida trigonal |
polar |
|
D |
XY4 |
Tetrahedral |
Non Polar |
|
E |
XY5 |
Trigonal bipiramid |
Polar |
18. Perhatikan gambar ilustrasi gaya intra molekul dalam etanol , C2H5OH dan intermolekul antara etanol dan air :
Ikatan hidrogen ditunjukkan oleh nomor ....
- 1
-
2
- 3
- 4
- 5
19. Berikut ini fenomena sehari-hari yang menunjukkan aplikasi sifat koloid :
- Proses cuci darah
- Proses menghilangkan bau badan dengandeodoran
- Penyaringan debu pabrik dengan alat cottrel
- Pembentukan delta di muara sungai
- Langit terlihat biru di siang hari
Sifat adsorbsi dan elektroforesa ditunjukkan oleh nomor ....
A. 1 dan 3
B. 2 dan 3
C. 2 dan 4
D. 3 dan 5
E. 4 dan 5
20. Perhatikan gambar beberapa zat terlarut non elektrolit dibawah ini!
Keterangan : = Partikel zat terlarut.
Apabila massa zat pelarut pada masing-masing bejana adalah tetap, larutan yang mempunyai titik didih paling kecil adalah...
- 1
- 2
- 3
- 4
- 5
21. Diketahui persamaan reaksi redoks sebagai berikut!
3Cl2 + 6OH- → 5Cl- + ClO3- + 3 H2O
Perubahan bilangan oksidasi Cl pada reaksi redoks tersebut adalah ….
A. +1 menjadi -1 dan +5
B. 0 menjadi -1 dan +3
C. 0 menjadi -1 dan +5
D. +3 menjadi +1 dan +3
E. +2 menjadi -1 dan +3
22. Perhatikan persamaan reaksi berikut!
Al3+(ag) + 3e → Al(s) Eo = -1,66 volt
Zn2+(ag) + 2e → Zn(s) Eo = -0,76 volt
Notasi dan potensial sel reaksi yang dapat berlangsung adalah…
- Zn│Zn2+ ││ Al3+│Al E0sel = - 2,42 Volt
- Al3+│Al ││ Zn│Zn2+ E0sel = - 0,9 Volt
- Al│Al3+ ││ Zn2+│Zn E0sel = 0,9 Volt
- Z n2+│Zn ││ Al3+│Al E0sel = 1,8 Volt
- Al│Al3+ ││ Zn│Zn2+ E0sel = 2,42 Volt
23. Elektrolisis dilakukan pada dua buah larutan secara seri dengan rangkaian seperti bagan berikut ini !
- 8.0 gram
- 16.0 gram
- 27.0 gram
- 36.0 gram
- 54.0 gram
24. Diketahui hasil percobaan tentang korosi sebagai berikut. Seorang siswa melakukan pengamatan penyimpanan sepotong besi dengan berbagai Kondisi sesuai gambar di bawah ini.
Dengan perlakuan tersebut dapat diperkirakan potongan besi yang paling cepat berkarat adalah pada kondisi nomor ….
- 1
- 2
- 3
- 4
- 5
25. Reaksi CH3CH2Cl → CH2 = CH2 + HCl disebut reaksi....
A. substitusi
B. adisi
C. polimerisasi
D. eliminasi
E. oksidasi
26. Berikut ini beberapa kegunaan senyawa karbon:
- Sebagai zat anestetik
- Pelarut zat nonpolar
- Bahan dasar pembuatan plastik
- Pengharum ruangan
- Pengawet mayat
Yang merupakan kegunaan formaldehida terdapat pada nomor…
- (4) dan (5)
- (4) dan (3)
- (3) dan (5)
- (2) dan (3)
- (1) dan (2)
27. Diberikan tabel yang berisi turunan benzena dan kegunaannya:
Hubungan yang tepat antara rumus struktur , nama senyawa dan kegunaan senyawa turunan benzena adalah....
- (1) dan (2)
- (1) dan (3)
- (2) dan (3)
- (3) dan (4)
- (4) dan (5)
28. Perhatikan tabel di bawah ini
|
No |
Polimer |
Monomer |
Jenis polimerisasi |
kegunaan |
|
1 |
Protein |
Asam amino |
Adisi |
Sumber energi |
|
2 |
Polietilena |
Propena |
kondensasi |
Bahan plastik |
|
3 |
Karet alam |
Isoprena |
Adisi |
Ban kendaraan |
|
4 |
PVC |
Vinilklorida |
Kondensasi |
Panci anti lengket |
|
5 |
Amilum |
Glukosa |
Adisi |
Zat anti bodi |
Berdasarkan data di atas, pasangan yang paling tepat dari keempat komponen tersebut ditunjukkan oleh nomor….
- 5
- 4
- 3
- 2
- 1
29. Berikut ini tabel data berisi batuan, logam yang dikandung dan penggunaannya:
|
No |
Logam |
Batuan |
Penggunaan |
|
1. 2. 3. 4. 5. |
Magnesium Besi Tembaga Alumunium Krom |
Magnetit Hematit Kalkopirit Bauksit Pirolusit |
Antasida transistor Alat-alat listrik Alat-alat rumah tangga Bahan bangunan |
data yang ketiganya berhubungan dengan tepat adalah ….
- 1 dan 2
- 1 dan 3
- 2 dan 3
- 3 dan 4
- 3 dan 5
30. Data percobaan uji protein berbagai bahan sebagai berikut:
|
Bahan yang diuji |
Tes |
||
|
Biuret |
Xantoproteat |
Pb-asetat |
|
|
Putih telur |
Ungu |
Jingga |
Hitam |
|
Susu |
Ungu |
- |
- |
|
Tahu |
Ungu |
- |
- |
|
Ikan |
Ungu |
Jingga |
- |
Berdasarkan data di atas, maka bahan yang mengandung protein dengan inti benzen adalah . . . .
A. putih telur dan ikan
B. susu dan ikan
C. susu dan tahu
D. putih telur dan susu
E. tahu dan ikan
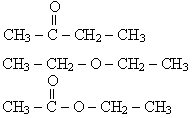
31. Senyawa organik dengan rumus:
berturut-turut termasuk . . . .
A. eter, keton, ester
B. eter, ester, keton
C. eton, ester, eter
D. keton, eter, ester
E. ester, eter, keton
32. Berdasarkan bagan sel di samping, penulisan lambang sel
yang tepat adalah … .
A. Zn | Zn2+ | | Cu2+ | Cu
B. Zn | Zn2+ | | Cu | Cu2+
C. Zn2+ | Zn | | Cu2+ | Cu
D. Zn2+ | Zn | | Cu | Cu2+
E. Zn2+ | Cu2+ | | Zn | Cu
33. Diketahui beberapa sifat sebagai berikut :
- ikatanlogamkuat
- titk didih rendah
- memiliki beberapa bilangan oksidasi
- senyawanya berwarna
- dapat membentuk senyawa kompleks
yang merupakan sifat unsur transisi adalah..
- 1,3,4,5
- 1,2,4,5
- 2, 3, 4, 5
- 1, 2, 3
- 1, 2, 3, 4
34. Radioisotop yang digunakanuntukmembunuhselkankeradalah ....
A. Tl-201
B. Xe-133
C. Tc-99
D. Fe-59
E. Co-60
35. Sifat – sifat suatu senyawa sebagai berikut:
- Senyawanya berwarna
- Bersifat paramagnetic
- Dapat membentuk senyawa komplek
- Mengalami reaksi oksidasi
Contoh senyawa yang mempunyai sifat tersebut adalah….
- NaCl
- FeSO4
- CaCO3
- Mg(NO3)2
- SrSO4
- SOAL ESSAY
36. Direaksikan dua mol gas nitrogen dengan gas hidrogen menurut reaksi:
N2(g) + 3H2 (g) → 2 NH3(g)
Volume gas yang dihasilkan jika diukur pada 0oC, 1 atm adalah ....
37. Data percobaan untuk reaksi A + B → AB diperoleh data sebagai berikut !
|
NO |
[A] M |
[B] M |
Laju reaksi ( M/detik) |
|
1 |
0,01 |
0,05 |
2 |
|
2 |
0,03 |
0,05 |
18 |
|
3 |
0,01 |
0,20 |
32 |
- Tentukan orde reaksi terhadap A dan B
- Tuliskan persamaan laju reaksinya.
38. Diketahui data potensial elektroda berikut!
Ag+ + e → Ag Eo = +0,80 volt
Mg2+ + 2e → Mg Eo = -2,34 volt
Berdasarkan data tersebut tentukan :
- Diagram sel
- Harga potensial sel.
39. Diketahui reaksi adisi berikut! CH3─CH2─CH═ CH2 + HCl → hasil , Tentukan:
- Hasil raksi
- Nama senyawa hasil raksi
- Tentukan isomer rangka dari hasil reaksi tersebut.
40. Lengkapi reaksi inti berikut!
- → + P
- → + Q
- + R → + β
- → + S
- + α →